益生菌产业深度解读 | 全球市场破千亿,中国出口如何破局?
发布日期:2025-04-28
益生菌作为一类具有活性的微生物,具有调节肠道菌群平衡、增强免疫力等功能特性,因此在食品工业领域展现出广泛的应用价值。
目前,主流的益生菌菌种包括双歧杆菌(Bifidobacterium)、乳杆菌(Lactobacillus)、芽孢杆菌(Bacillus)等。
在食品市场中,益生菌广泛融入功能性食品与饮料、膳食营养补充剂、保健食品、奶制品和婴幼儿配方奶粉等产品类别,满足了消费者对于健康、营养食品的多元需求。

益生菌的全球市场和美国市场
在全球范围内,消费者对肠道健康和免疫调节的关注度与日俱增,有力推动了益生菌市场的高速扩张。
根据Grand View Research、NIH Market Research等机构在2024年发布的数据,2024年全球益生菌市场规模介于610亿至650亿美元之间,预计到2030年,全球市场将以7%-8%的复合年增长率持续上涨。
美国作为全球更大的益生菌消费国之一,2024年其益生菌市场规模约在90亿至100亿美元区间,复合年增长率将达8%-9%,增速略高于全球均值。
从市场结构看,美国增长最快的益生菌细分市场仍然是膳食营养补充剂,与此同时,消费者对精准化益生菌产品的需求正快速升温 —— 针对免疫提升、女性健康、口腔健康、运动健康等特定需求研发的定制配方,正吸引着越来越多消费者的目光。
行业头部企业动态
2021年,美国的国际香精香料公司(IFF)正式完成了与杜邦营养与生物科技业务(DuPont N&B)的合并,此后跻身全球益生菌生产商前列。
其余知名的益生菌生产企业也大都位于欧美,比如丹麦诺维信(Novozymes)和科汉森(Chr.Hansen)合并成立的诺和新元(Novonesis)、加拿大的拉曼公司(Lallemand)、瑞典的普诺碧(Probi AB)公司、爱尔兰的凯爱瑞集团(Kerry Group公司)等。前几名行业龙头公司占据了全球益生菌市场的70%甚至更高的市场份额。
中国益生菌出口情况
中国的益生菌市场从2020年以后也在迅速发展,据“中研普华产业研究院”发布的报告显示,2022年中国益生菌市场规模已达到1065亿元,后续年增长率可以达到每年11%-12%,预计2026年中国益生菌市场规模将有望达1377亿元。
相比较而言,中国企业的益生菌出口金额与市场规模相比要低得多,据“前瞻产业研究院”数据统计,2022年中国益生菌出口金额为1.97亿元,较上一年同比增长17.3%,其中美国、加拿大是中国益生菌的主要出口目的国,出口品类涵盖菌粉、冻干粉以及复合益生菌制剂。
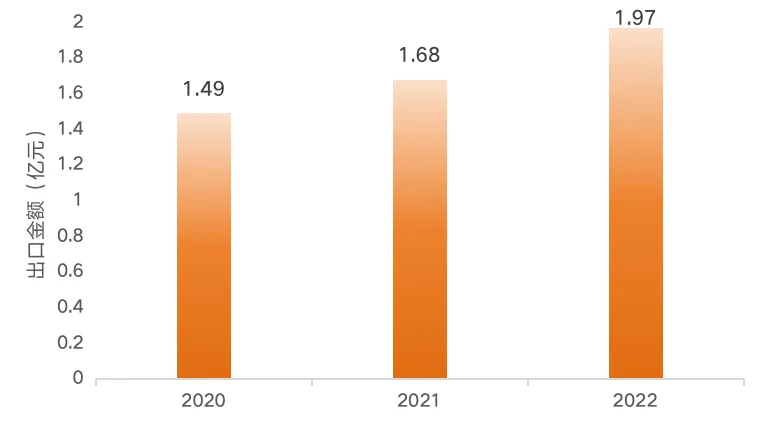
数据来源:海关总署
总的来说,中国企业需持续投入研发以缩小技术差距,但综合市场前景、差异化的消费品需求、技术提升空间、政策等来看,益生菌行业的发展前景是广阔的,出口也大有可为。
益生菌出口美国市场的合规路径
美国现行法规体系中未设立"益生菌"独立监管类别,其管理机制根据产品功能定位实施分类监管。
如果益生菌应用于普通食品,那么需要符合法规中普通食品安全标准,属于新成分的需要完成食品添加剂请愿(Food Additive Petitions,FAP)或普遍认为安全认证(Generally Recognized As Safe,GRAS)。
如果益生菌应用于膳食补充剂,那么需要符合法规中膳食补充剂的膳食成分定义,属于新成分的可以选择新膳食成分通知(New Dietary Ingredients Notification,NDIN)路径,也可以沿用普通食品新成分的路径(即FAP和GRAS)。
被称为下一代益生菌新星的AKK菌 (Akkermansia muciniphila,嗜黏蛋白阿克曼菌)就属于新成分,善恩康生物科技有限公司通过GRAS认证途径将其旗下的AKK PROBIO出口美国,美国ADM Deerland也曾计划将AKK菌应用于膳食补充剂而申请过NDIN。
如何进行GRAS认证申请?
路径选择
理论上,任何机构或个人均可以通过以下任一途径申请GRAS认证。
自我声明GRAS
即Self-affirmed GRAS,通过找有资质的专家组评审签字,形成不通报FDA的GRAS评估材料,不对外公开信息。
FDA GRAS
即 FDA notified GRAS,需要形成GRAS评估材料后通报FDA ,由FDA专家进行评估,并需要获得FDA的正面批复。
需注意的是,FDA notified GRAS通常也需要在评估材料中包含自我声明GRAS专家组的意见结论。
简言之,通过自我声明GRAS即可在美国销售该物质,通过FDA GRAS在市场宣传方面更有利,但需要的周期更长,企业可以根据自身市场计划进行选择。
申请企业需要准备全英文的GRAS评估材料,涉及如下七大块内容:
01 签署声明和保证;
02 物质信息,包括物质鉴定、生产工艺、辅料信息、质量标准等;
03 膳食暴露,即根据拟使用范围、使用人群及使用量,结合饮食中该物质的所有来源,评估膳食摄入量情况;
04 物质自限性水平;
05 食品中使用历史;
06 安全性阐述/论证,主要基于毒理试验数据论证物质安全性,如必要,还需包含人体临床研究数据。
07 支持性资料,如参考文献、检测报告等。
常见问题
Q1. 如何判断产品是否适合GRAS认证?
答:如果产品中含有新研发的食品成分或者采用新生产工艺的食品成分,且在其预期用途下是公认安全的,那么该产品可以申请做GRAS认证。
Q2. 如果已有企业的产品通过GRAS认证,是否仍需单独申请吗?
答:需要!美国境内一般只认可通过GRAS认证的企业产品。
Q3. GRAS认证申请的周期需要多久?
答:由于自我声明GRAS不需要经过FDA审评,时间相对可控,如果生产工艺并不特别复杂,且不需要补充长期测试,整体流程预计6-9个月。FDA GRAS需要等待FDA官方审核材料,审核的时间可能需要花费6-9个月,整体流程预计1.5-2年。

本内容来源于互联网,如若侵权请及时联系我们,我们将按照规定及时处理。
来源:https://www.reach24h.com/food/industry-news/probiotics-export-market